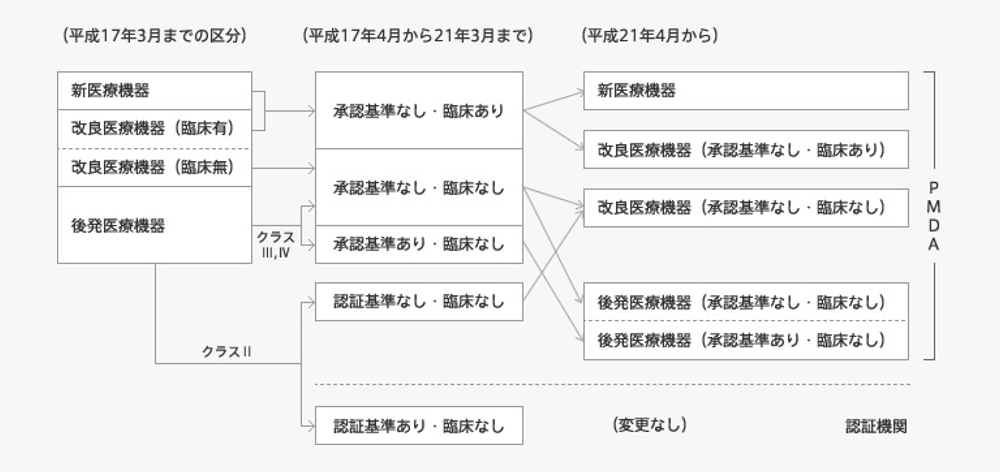
医療機器の製造・販売には、「届出」、「認証」あるいは「承認」が必要になります。リスクが極めて低いクラスⅠの医療機器は医薬品医療機器総合機構(PMDA)への届出(自己認証)のみになり、臨床試験成績(治験成績)の提出は不要です。また、大部分のクラスⅡ、一部のクラスⅢの医療機器には認証基準注1)があり、第三者認証機関が審査します。この場合も臨床試験成績の提出は不要です。このため、治験の対象は、PMDAによる承認審査を受ける一部のクラスⅡやクラスⅢ、Ⅳの医療機器に限られます。
PMDAによる承認審査は、医療機器は改良・改善で進化するものが多いため、下図のように新医療機器、改良医療機器、後発医療機器の3つのトラック注2)に分かれ、また、臨床試験成績の要否(「臨床あり」、「臨床なし」)、承認基準の有無に基づいて行われます。ここで、原則、治験が必要なもの(「臨床あり」)は、さらに、新医療機器や改良医療機器の一部に限定されます。
PMDAで承認された医療機器の品目数を、承認申請区分別で見ると分かりますが、臨床試験成績を必要としない改良医療機器(臨床なし)や後発医療機器(臨床なし)の件数が多く、全体の90%を超えています。
承認申請区分別 医療機器承認品目数
| 平成26年度 | 平成27年度 | 平成28年度 | 平成29年度 | 平成30年度 | |
| 新医療機器 | 67 | 56 | 26 | 27 | 38 |
| 改良医療機器(臨床あり) | 35 | 53 | 44 | 42 | 52 |
| 改良医療機器(臨床なし) | 213 | 240 | 225 | 215 | 216 |
| 後発医療機器 | 917 | 868 | 825 | 868 | 799 |
独立行政法人 医薬品医療機器総合機構 平成30事業年度業務実績より
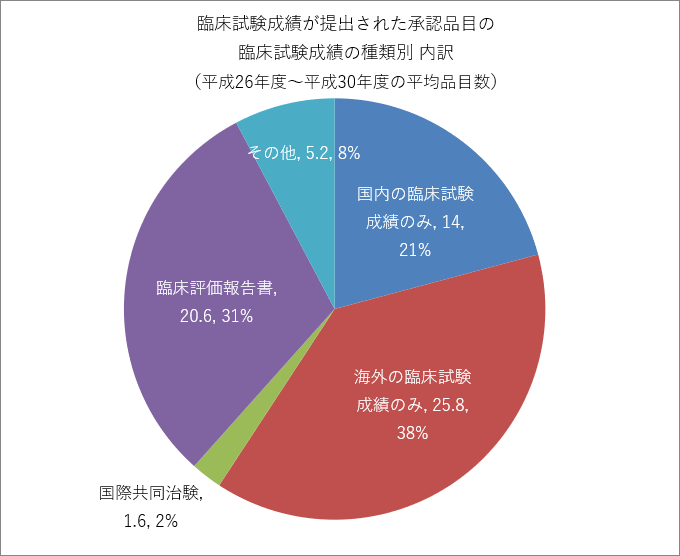
また、全体の10%にも満たない臨床試験成績が提出された承認品目を見ると、ステント・カテーテルなどの海外製品のものが多数を占めるため、「海外の臨床試験成績のみ」や「臨床評価報告書注3)」で承認を受ける割合が多くなっています。
臨床試験成績が提出された承認品目数の内訳
| 平成26年度 | 平成27年度 | 平成28年度 | 平成29年度 | 平成30年度 | |
| 国内の臨床試験成績のみ | 10 | 23 | 9 | 14 | 14 |
| 海外の臨床試験成績のみ | 24 | 23 | 25 | 26 | 31 |
| 国際共同治験 | 0 | 2 | 3 | 2 | 1 |
| 臨床評価報告書 | 37 | 23 | 13 | 11 | 19 |
| その他 | 5 | 10 | 4 | 2 | 5 |
注)その他は、海外臨床試験成績+国内臨床試験成績を併用した品目など
独立行政法人 医薬品医療機器総合機構 平成30事業年度業務実績より
医療機器の場合、臨床試験成績を必要とする品目が非常に限られていること、さらに、臨床試験成績を必要とするリスクの高い医療機器は海外製品が多いため、国内での臨床試験(治験)を必ずしも要求していないことが、医薬品と大きく異なるところです。
一方、「届出」、「認証」、「承認」において臨床試験成績の提出が不要であっても、改良・改善で進化する医療機器では、臨床研究による評価が非常に重要になります。このため、医療機器の有効性・安全性の検証的な評価とともに、医療機器の性能評価やユーザビリティ注4)の評価などを含め、多くの探索的臨床研究が実施されています。
(2019年12月18日時点の記載です。)
(注1)厚生労働大臣が基準を定めたものについて大臣の承認を不要とし、あらかじめ厚生労働大臣の登録を受けた民間の第三者認証機関が基準への適合性を認証する制度で用いられる適用範囲、技術的な基準、使用目的又は効果で構成された医療機器の認証基準
(注2)新規性の程度によって審査プロセスを明確化するために導入された3区分(新医療機器・改良医療機器・後発医療機器)による審査体制
(注3)医療機器の臨床的な有効性及び安全性が性能試験、動物試験等の非臨床試験成績又は既存の文献等のみによっては評価できない場合は、臨床試験(治験)の実施が必要です。しかし、臨床試験成績に関する資料の提出が必要な範囲の機器であっても、既存の文献等によって評価可能と考えられる場合には、「臨床評価報告書」でもって臨床試験成績に代えることが出来ます。
(注4)医療機器のユーザビリティが適切でないために起こる使用時のエラーによるリスクを低減することが益々重要になっています。このため、2015 年に発行された IEC 62366-1を基に、国内においても、2019年10月1日にJIS規格(JIS T 62366-1:2019 医療機器―第1部:ユーザビリティエンジニアリングの医療機器への適用)が制定されました。また、同年10月3日には厚生労働省から「ユーザビリティエンジニアリングの医療機器への適用に関する日本産業規格の制定に伴う医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律上の取扱いについて」(薬生発1001第1号・薬生監麻発1001第5号)が発出されています。