医療機器を用いた臨床研究に関するアンケート調査結果報告
調査目的
医療機器は医薬品と特性が大きく異なり、その特性に応じた適切な臨床研究を実施することが重要になる。このため、京大病院では、先端医療機器開発・臨床研究当センターと臨床研究総合センターが連携して、医療機器を用いた臨床研究の計画書作成を効率的に行うためのプロトコル雛型の作成、情報発信等を行ってきた。こうした中、2014年11月25日に医薬品医療機器等法が施行され、また、12月22日に統合指針「人を対象とする医学系研究に関する倫理指針」が公布されることから、医療機器を用いた臨床研究を一層活性化するために、臨床研究中核病院整備事業の一環として、学内外の有識者による検討委員会「医療機器を用いた臨床研究の活性化に関する検討委員会」を発足させ、医療機器を用いた臨床研究プロトコル雛型の改訂・情報発信等に関する検討を進めることとした。本アンケート調査は、医療機器を用いた臨床研究の実施に関する状況を把握し、臨床研究プロトコル雛型の改訂に反映させることを目的に実施したものである。
調査対象
「臨床研究中核病院」、「早期・探索的臨床試験拠点」の15拠点の事務局、並びに「メディカルエシックス49 医学系大学倫理委員会連絡会議編」に掲載されている72機関の倫理審査委員会を対象とした。
謝辞:本アンケート調査には、非常に多くの臨床研究実施機関からご協力を賜わりました。この場をお借りしまして改めて深く感謝申し上げます。臨床研究プロトコル雛型に反映できていないご要望等も多々あるかと思います。お気づきの点、ご意見等がございましたら、「お問い合わせ」の窓口にご連絡をお願いいたします。引き続き、ご指導、ご助言をよろしくお願い申し上げます。
調査期間
2014年12月1日~2014年12月31日
調査方法
アンケート回答票を郵送で送付・回収した。ただし、デジタルファイル希望の場合は、eメールでの送付・回収を可とした。
回収状況
回答率
| 送付機関数 | 回答数(回収率) | |
| 【15拠点】 | 15 | 14(93%) |
| 【15拠点以外】 | 72 | 41(60%) |
| 【全体】 | 87 | 55(63%) |
回答者属性
| 国公立大学 | 34機関 |
| 私立大学 | 16機関 |
| 国立高度専門医療研究センター | 5機関 |
調査結果
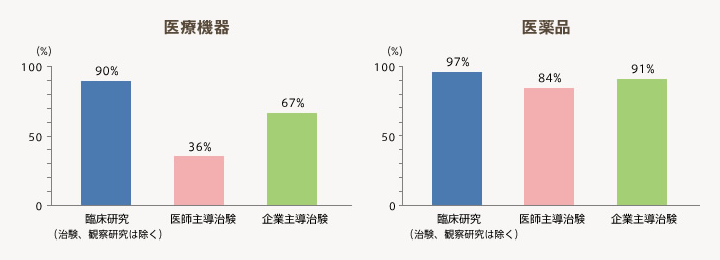
- 医療機器と医薬品の臨床研究(治験、観察研究は除く)は、それぞれ全体の90%、97%の機関が実施している。一方、医療機器の医師主導治験は、全体の36%と半数以下の機関が実施するに留まっている。
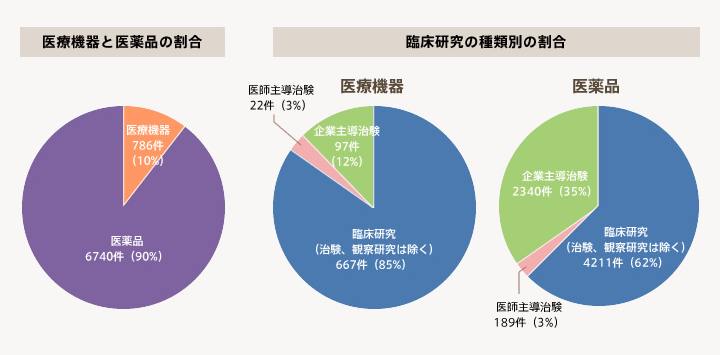
- 実施件数はカウントの方法が各機関で異なるため参考値となるが、医薬品と医療機器の実施件数は9:1の比となり、医療機器の件数は圧倒的に少ない。また、医療機器では臨床研究(治験、観察研究は除く)の実施件数が全体の85%と大きく、企業治験が12%と少ないのに対して、医薬品では企業治験の実施件数が全体の35%と比較的大きな割合を占めている。
有効回答55機関の中で「臨床研究」を実施している機関の割合
有効回答54機関の「臨床研究の実施件数」
(医療機器と医薬品の合計のみを記載している1機関は除く)
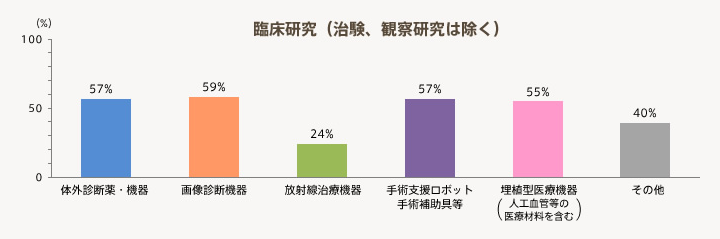
- 医療機器の臨床研究(治験、観察研究は除く)は、「体外診断薬・機器」、「画像診断機器」、「手術支援ロボット、手術補助具等」、「埋植型医療機器(人工血管等の医療材料を含む)」を対象とした臨床研究を半数以上の機関が実施している。「放射線治療機器」は24%と少ない。
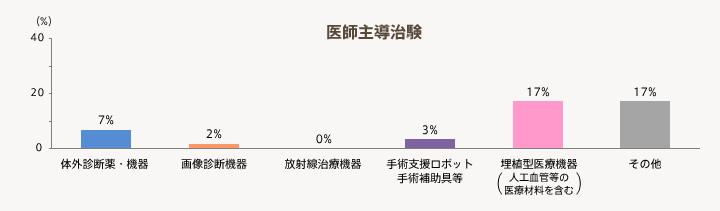
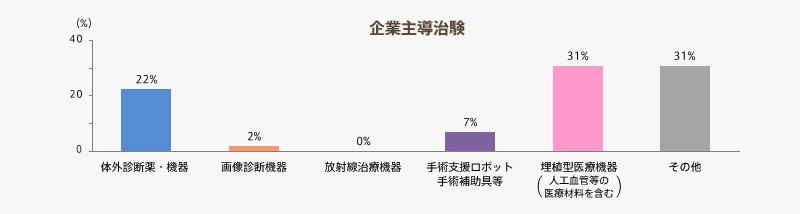
- 医師主導治験は、「埋植型医療機器(人工血管等の医療材料を含む)」を実施する機関が17%と比較的大きい。
- 企業治験は、「体外診断薬・機器」と「埋植型医療機器(人工血管等の医療材料を含む)」を実施している機関がそれぞれ22%、31%と比較的多い。
有効回答55機関の中で「医療機器の臨床研究」を実施している機関の割合
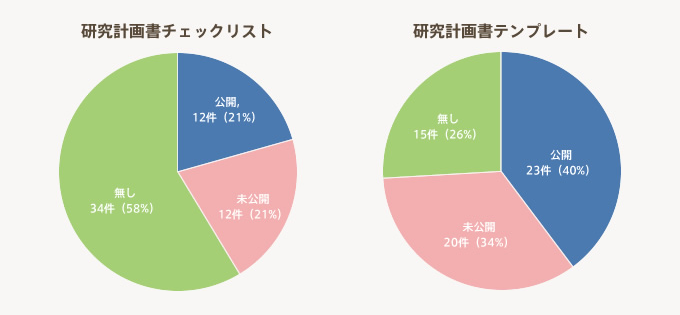
- 研究計画書のテンプレートは74%の機関が整備しているのに対して、チェックリストは42%に留まっている。
- 整備しているチェックリスト、テンプレートはほぼ半数の機関が公開している。
「研究計画書チェックリスト、テンプレート」の整備状況
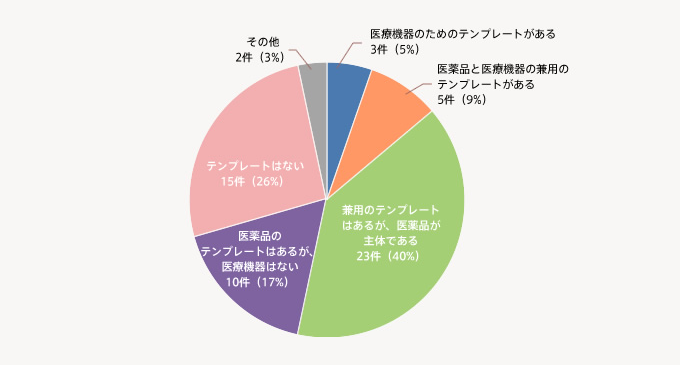
研究計画書のテンプレートの整備状況は、医薬品のテンプレートあるいは医薬主体のテンプレートを整備している機関が57%と半数以上で、医療機器のテンプレート、医療機器と医薬品の兼用テンプレートを整備している機関は全体の14%となっている。また、テンプレートが無い機関は26%となっている。
「医療機器の研究計画書テンプレート」の整備状況
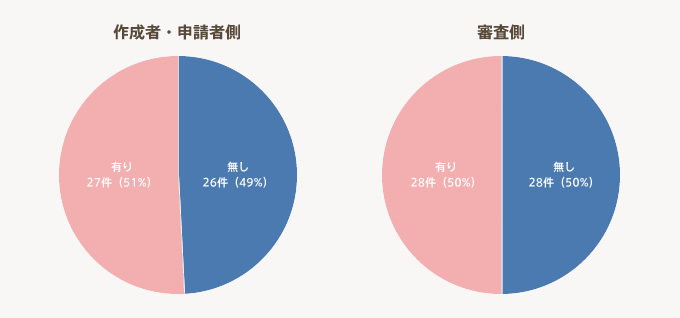
- 医療機器の臨床研究(治験、観察研究は除く)の研究計画書に関して、「作成者・申請者側」、「審査側」ともに半数以上の機関が課題ありとしている。
- 「作成者・申請者側」、「審査側」ともに医薬品とは異なる医療機器の取扱いについて課題を挙げている。
「研究計画書に関する課題」の有無の割合
研究計画書(実施計画書)に関する「作成者・申請者側」の主な課題
- モニタリング、DMの医療機器特有の部分の記載方法
- 実施者、コーディネータ共に経験不足の為、プロトコル作成に時間がかかる。
- 患者に疼痛や苦痛がない装置を使用するようにしている。薬事法が通っている機器の方が申請しやすい。申請書の項目が多い為、漏れが無いように記入するのが難しい。どこをおさえて記入しないといけないのか、チェックリストがあるとわかりやすい。レビュアーによって、審査基準がさまざまであるため、統一的な基準を設けて欲しい。
- 保険・補償の範囲
- 医療機器提供者との利益相反のマネジメントが困難な場合がある。
- 救命的な臨床研究(高リスクな対象者に適応外の機器を救命的に用いる等)
- 適応内と適応外の違いが困難
- 医薬品と比較し、未承認の定義が困難
- 特殊な分野においては、審査ができる専門家がほとんどいない。
- プロトコルの完成度が高くない。一課題あたりの審査時間を短くする必要がある。
- 医療機器に特有の審査ポイント等が明確になっていない。
- リスク分類とそれに対応する補償について
- 専門知識を有する者がいなかったため、安全性等における倫理性や妥当性の議論が困難であった(特に革新的な新規の機器の場合、人体に及ぼす影響、侵襲の程度等の理解が困難であった)。
- 構成、項目が各研究課題によって大きく異なるため、同じ審査基準で対応しにくい。
- とりたてて医療機器に詳しい委員を選定していないこと
- 医療機器についての専門性を有する審査員がほとんどいない。
- 機器の安全性が審査できない。
- 操作する医療者の能力の客観的な判定基準がない。
- 実施計画書の記載項目が不十分であり判断に困る場合がある。
- 医療機器の特殊性から、記載項目について記入されている内容で問題ないか判断に困る場合がある。
- 専門性が高いので、理解しづらい。
- 臨床研究で行われる新規の医療機器の安全性をどこまで求めるか。
- 術中に臓器に接触する診断医療機器について、どのレベルまでその材料の安全性についてのデータを求めるかについて
- 被験者に危険が伴わないかを一番に審査しているが、機器によっては委員だけで判断が難しい事もある。
- 印象として国内市場を考えすぎている感じがする。
- テンプレートが無いため、研究者によって形式が異なり、確認に時間がかかる。
- 利益相反にからんで、提供等を受ける機器の評価額が不明である。
- 医療機器の評価方法が確立していない。
- 医療機器に特化した申請書式を作成する必要がある。
- 多様な種類に対応できる専門家がいない。
- 試験デザイン選択の適切さ
- 症例数設定の根拠が薄弱
- 審査する側も、医薬品と比較した場合、内容も多種多様である為、審査に関しても統一的な取扱いが実現できていない側面があります。
- 国内及び海外での該当品や類似品の承認情報を得ることが難しい場合があり、作成者・申請者からの情報に頼らざるを得ない場合がある。
- 統一されたテンプレートが存在せず、プロトコルに記載すべき内容、順序がまちまちであるため、効率の良い審査が困難である。
- レビューワーの品質、視点が一定ではなく、一定の基準に基づいた審査が困難である。
- 評価法の設定が難しい場合がある。
- 有害事象、不具合に対する考え方、取扱いが難しい場合がある。
- 機器自体の特性について専門家が入っていないので、理解不足となることがある。
- 委員の理解にばらつきがある。
- 被験者の安全面について
- 介入によって新たに加わると予想される危険性について
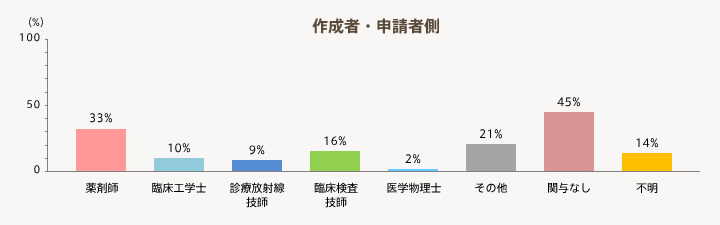
- 「作成者・申請者側」では、薬剤師が関与している機関が33%と多く、臨床検査技師16%、臨床工学士10%と続く。
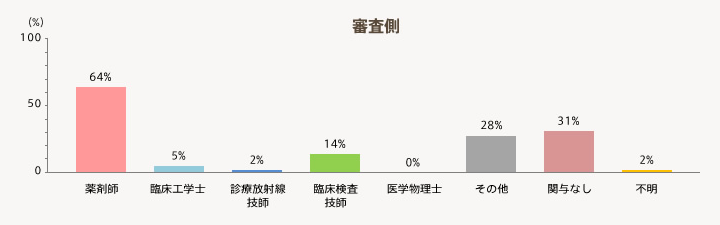
- 「審査側」では、薬剤師が関与している割合が64%と半数を超える。
「資格を有する人材」が関与している機関の割合
「医療機器京大テンプレートに対する評価」の割合
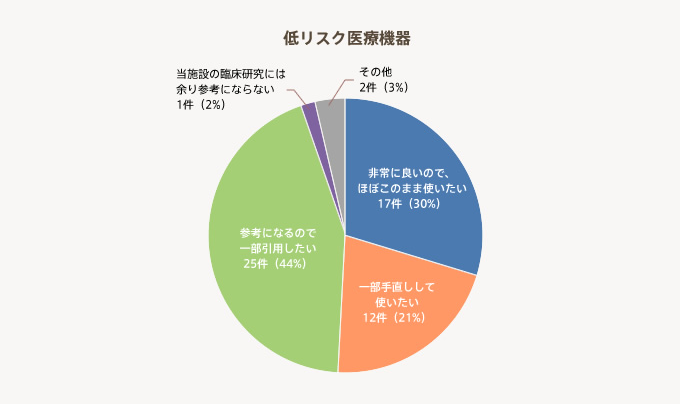
「ほぼこのまま使いたい」30%と「一部手直しして使いたい」21%を加えると、約半数の機関がテンプレートを利用したいと回答している。また、「参考になるので一部引用したい」の44%を含めると95%の機関が医療機器の臨床研究のテンプレートを評価している。
医療機器京大テンプレートの評価
- 既に作成している医薬品のテンプレートと整合性をとる必要がある。
- 使う場合はほぼこのまま使いたい。これまでの様式(医薬品を参照している)があり、特にこのテンプレートを使わなくても作成できる為
- 当学においても、現在テンプレートを作成中の為、大変有用な情報だと思います。
- 注意点が赤字で示され、記入部分を【】や●で示されており、申請者がどこに記入をすれば良いのかが分かりやすく示されていると感じました。必要項目も全て挙げられているので、申請側も作りやすいと思います。
- モニタリングなどを含む新指針への対応が必要
- 医薬品のテンプレートとの整合性をとる必要がある。本学の定型文と異なる文章がある。
- 自大学の指針、手順書との整合性を取る必要がある。
- 全体的には十分な内容と考えるが、データ解析及びデータの質の保証の為の規定等についての記載が多少不足しているものと思われる事、知財関連の内容についても記載できる方が望ましいと思われるため、一部を引用して作成したいと考えている。
- 平成27年4月より疫学と臨床の倫理指針が統合され、新しい人を対象とする医学系研究に関する倫理指針が施行されるため一部引用したい。
- 当院にこのようなテンプレートがないため、ほぼこのまま使いたい。
- 大変良いと思いますが、以下の点を追加してはどうかと考えます。モニタリング、監査に関する記載。書き慣れていない者のために、例文を入れる等してより具体的にわかりやすくする。
- 当院では実施計画書作成手引書や申請書の医療機器用フォームが既にあるため、余り参考にならない。
- 現在、当院では、医療機器の治験、臨床研究の実施件数が少なく、医療機器用の臨床研究実施計画書のテンプレートを持っていない。現在のテンプレートは、基本的事項が網羅されているので、当院で利用する場合には、さらに詳細な記載を要求するものに変更する可能性がある。
- 医療機器に特化した部分を参考にさせていただき、医薬品と医療機器の共通の部分は、本院の雛形で対応したい。
- 他の臨床研究計画書作成の際にも十分応用可能な優れたテンプレートだと思います。誤使用や不具合に起因して被験者に生じる有害事象に加えて、誤使用や不具合自体の記録も必要と思うのでその点を追記して使いたいと思います。
- 医薬品の臨床研究計画書に準じて、必要な項目は出尽くして、ほぼ完成された書式であると思います。
- 必要とされる記載事項が網羅されている。
- 当院においてもテンプレートはあるが、近々改訂を予定している。不足分を補い、より充実したテンプレートとするため、ご提供いただいた内容を参考にさせていただきたい。
- 統合指針への対応が必要
- 本学ではまだ医療機器を用いた臨床研究の計画書の検討は行われていないので、とても参考になる。
- 唐突に送付されてきて、すぐ、そのまま使うとは言えないが、良くできていると感じている。
- 当方でもテンプレートの改訂の必要に迫られているが、委員より様々な意見を受けているため。
- 現在、当院の研究実施計画書のテンプレートが無いため、研究者、審査員ともに作成や確認作業に時間がかかっている。今後のテンプレート作成の際に参考にさせていただきたい。
- 一部の記載が当院の実情と合わない為
- 当施設にて使用中のテンプレートがあるので、その版と整合性を検討後に手直しして、使わせて頂ければ有難いです。
- 医療機器を用いた臨床研究実施計画書の雛形を専用には作っていないので、参考にさせて頂きたい。
- 当施設の規定の書式に合わせる必要があるため
- 是非参考にしたいです。
- 必要不可欠な項目であり、使用しやすいと思う。
- 当院として他に必要とする事項などないか検討し、活用させていただければと考えます。
- 医薬品のテンプレートと記載順等比較して整備したい。本院のみ実施/他施設共同試験としての実施、本院がすでに経験した具体例等を更に追加したい。また、医薬品・医療機器両方使用の計画もあるため、テンプレートを分別する事がよいのか、否かについては、院内で協議の上実施したい
- SAE発生時の対応、厚労省への報告等についても記載があると良いかと思います。
- 1年に一度以上の中間報告について、記載が見当たりませんでしたが、不要でしょうか。
- 医療機器の臨床研究の際に懸念されるのが、操作者・測定者への安全性の確保です。有害事象の対象にもならず、労災適用範囲とするのか、別途対応を考慮・記載すべきなのか悩みます。操作者・測定者のための、安全確保対応等について、一文でも良いので追加していただけますと、本学のテンプレートにおける説得材料になるかと思います。
- 本テンプレートの適用範囲(表紙・注意書き)には、低リスク医療機器とありますが、項目に、クラス分類を記載する項目等があり、特に探索的臨床研究においては、これを記載する意味が不明瞭かと思います。
- 未承認の医療機器の臨床研究については、治験か性能試験かを検討する必要がありますが、いずれにせよ、探索的臨床研究の範囲ではないかと考えます。
- 医療機器を用いた臨床研究の数は医薬品と比べると少なく、医療機器に特化したテンプレートをアップデートするのが困難です。定期的に改定頂けるのは大変ありありがたく思います。
- 選択肢を増やして、記載の省略化ができるとよい。
- モニタリングなどを含む新指針への対応が必要
- 安全性の詳細なデータの添付あるいは項目が審査には必要
- 根本的な違いがある事は理解しているが、なるべく医薬品と医療機器でプロトコルの記載するレベルの差が無いような方向で検討していただきたいと考える。
- 本調査を反映した実施計画書のテンプレートについて、本学でも参考にさせていただきたい為、可能でしたら配布または公開をしていただけますと幸いに存じます。
- 「人を対象とする医学系研究に関する倫理指針」に適合するようにしてほしい。
- 不具合の説明も入れた方が良いと思います。
- モニタリング、監査に関する記述と、記載内容の具体例を入れて頂けると良いと思います。
- 医療機器を承認範囲で使用する臨床研究を審査対象としており、今回のアンケートにお答えできる項目は少ない。
- 治験では、「治験機器又は製造販売後臨床試験機器との因果関係の有無に関わらず、当該治験機器又は製造販売後臨床試験機器の使用時に被験者、使用者その他の者に生じた全ての好ましくない又は意図しない疾病又は障害並びにその徴候(臨床検査値の異常を含む)をいう。ただし、被験者以外の者に生じたものについては、治験機器又は製造販売後臨床試験機器の使用による影響と疑われるものに限る」とあります。臨床研究では、ここまで広げる必要はないでしょうか?
- 重篤な有害事象につながる恐れのある不具合についても記載が必要です。「被験機器等の不具合の発生であって、当該不具合によって死亡その他の重篤な症例等が発生するおそれがあるもの」も報告対象となり得ます。
- 使用前に試験機器の不具合が発生した場合も想定されるので、この場合の規定も必要かと思います。
- 説明文書の項目内容の箇条書きを載せる必要があると思われます。
- 試験の当該機器メーカーと試験責任医師、試験分担医師とのあいだにCOIに該当する事項(寄附金、講演謝金などの有無、労務提供の有無など)が具体的にあるのか無いのか、あるとすればどのようなものか、実施計画書及び説明文書に開示することが必要です。利益相反管理が適切に行われている、と記載するのでは不十分と考えます。
- 医療機器の場合、基本的に臨床研究保険に加入するのが基本と思われますが、加入しない場合とはどのような場合でしょうか。補償の他に賠償は記載しなくて良いでしょうか。
- 研究全体の中止の記載はありますが、個々の症例の中止基準が必要です。
- データの二次利用についての記載が必要です。
- 記録の保存の記載が必要です。
- 10月以降はモニタリング・監査の記載が必要です。
- 医療機器の試験において触れておいた方がよい内容としては、未承認医療機器の提供等に係る薬事法の適用について、植込み型機器の場合、試験中止の際、取り出せるか否か(この点は説明文書にも記載が必要と思います)
- 消耗品や故障等の場合のサポートの継続性
- ISOのGCPでは、試験機器及び試験計画に対するリスクベネフィットを記載することになっています。
- 誤使用や不具合の記録も必要と感じました。
- 現在は「医薬品」、「医療機器」の二分類ですが、将来的には、さらに「医療材料(医用材料)」という範疇を設けるべきだと思います。
- Ⅰ~Ⅳのリスクに基づくクラス分類とともに、その医療機器がどのような名称で呼ばれているのか、分かる範囲で記載する項目があればと思います。(類別名称)-(中分類名)-(一般名)[まったく新規の医療機器で、分類しようがない場合は空白で可]
- 医療機器の臨床研究のもっとも基本となっている「医療機器の臨床試験の実施の基準に関する省令」(厚生労働省第36号/平成17年3月23日設定/所謂「医療機器GCP」といわれる)に則って実施する…という文言を臨床計画書の冒頭あたり(倫理の項目の後)に入れればよいと思います。
- 「利益相反」と「モニタリング」に関する項目を追加して欲しい。
- 統合指針に沿ったテンプレートがあれば、是非とも使いたいと思います。
- 非常に参考になった。しかし、すぐに使うあてはないので、要望というものはない。臨床医でも取りかかりやすい構成にして欲しい。
- 4月1日からの統合指針への対応を明記して頂ければと思います。「京大の」フォーマットに留まらず、「医学研究業界のスタンダード」として今後発展していかれますことを心よりご期待申し上げます。
- 研究者からは作成しやすく、審査委員からは確認しやすい穴埋め式のテンプレートの作成
- 「人を対象とする医学系研究に関する倫理指針」が公布されましたので、ご対応いただきますようお願い致します。
- 同意書の雛形も有れば良いと思います。
- 医療機器メーカーの多くは、臨床研究や臨床試験そのものに関する理解が不十分な場合が多く、これがプロトコルの不備につながっている。そのため本プロトコルの有用性は高いと考えられるが、願わくば、文書を形式的に整えるにとどまらず、「作成の手引き」などの形で、各項目の意義や背景などについて解説を加えることとされてはいかがでしょうか。
- テンプレートを全国の施設で共有させていただくことによって、プロトコルの品質の向上、審査の効率化を目指すことはできないでしょうか。
- 先進医療、医師主導治験などの場合などのバリエーションがあると良いと思いました。
- 本アンケート結果をもとにテンプレート改正等がございましたら、報告頂けると助かります。
- 医療機器の臨床研究で特に留意すべき事項の注釈がほしい。例えば、研究実施後の医療の提供について、クラス分類での相違点があれば、注釈が欲しい。
- どのリスクでも使用可能な汎用性のある雛形が欲しい。
