臨床研究法は2018年4月1日に施行され、厚生労働省より臨床研究を実施する上での疑問点に対するQ&Aや事例集などが発出注1)されています。しかし、多様な医療機器では解釈に困難が伴うことが多いのも事実です。
「臨床研究法の対象となる臨床研究」は、①「医薬品・医療機器等を人に対して投与または使用する研究」、②「医薬品・医療機器等の有効性又は安全性を明らかにすることを目的とした研究」の2つ要件を共に満たすものとなっています。さらに、「人に対して投与又は使用する行為のうち、医行為に該当するもの」と規定されています。
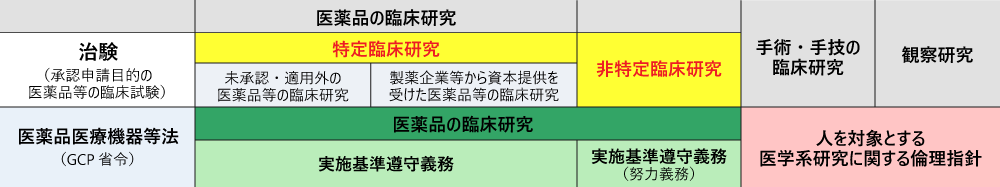
(厚生労働省ホームページの資料より一部改変)
「臨床研究法の対象となる臨床研究」には、「特定臨床研究」と「非特定臨床研究」があります。このうち、(a)未承認・適応外の医薬品等を⽤いて実施する臨床研究、(b)製薬企業等から資⾦提供を受けて実施する臨床研究が「特定臨床研究」となります。 このため、未承認での機器開発の段階では、まず、「法の対象となる臨床研究」の該当性を判断することが必要です。その判断におけるポイントは以下の通りです。
| 臨床研究法の該当性―判断ポイント | 非該当の事例 |
| 1) 医療機器に該当しないものか? | 福祉機器等 |
| 2) 薬機法に基づくものか? | 治験、再審査・再評価等の製造販売後調査、適合性試験等 |
| 3) 医療機器の評価を伴わないものか? | 手術・手技の評価、バイオマーカ探索・病態解明、使用感の評価等 |
| 4) 人に対して投与・使用しないものか? | 生体試料を用いた検査機器の性能評価等 |
| 5) 医行為を伴わないものか? | 侵襲性のない検査機器の性能評価等 |
| 6) 観察研究か? | 患者のために最も適正な医療を提供した結果として診療情報又は試料の収集により得られた情報を利用する研究 |
(厚生労働省講演資料より一部改変)
このうち、「医行為」は「医師の医学的判断及び技術を持ってするのでなければ人体に危害を及ぼし、又は及ぼす恐れのある行為」とされていますが、具体的に個別に判断する必要があるため、その範囲は明確ではなく、特に、低リスクの新しい診断機器を開発している医工学の研究者にとって大きな問題となっています。このため、日本生体医工学会では、「医工学研究における臨床研究法の該当性判断ガイドライン」注2)を作成し、公開しています。
(2019年12月19日時点の記載です。)
(注1)厚生労働省ホームページ「臨床研究法について」
(注2)日本生体医工学会ホームページ「臨床研究法の該当性判断ガイドライン」